作者丨因果
来源丨医学界肿瘤频道
蒽环类药物(Anthracyclines)是抗肿瘤常用药物之一,特别是针对乳腺癌、白血病、淋巴瘤、卵巢癌和肺癌等。
蒽环类药物基本结构为蒽环与一个氨基糖以糖苷键相连,从化学结构分类,蒽环类药物属于抗肿瘤抗生素,是由微生物产生的具有抗肿瘤活性的化学物质。
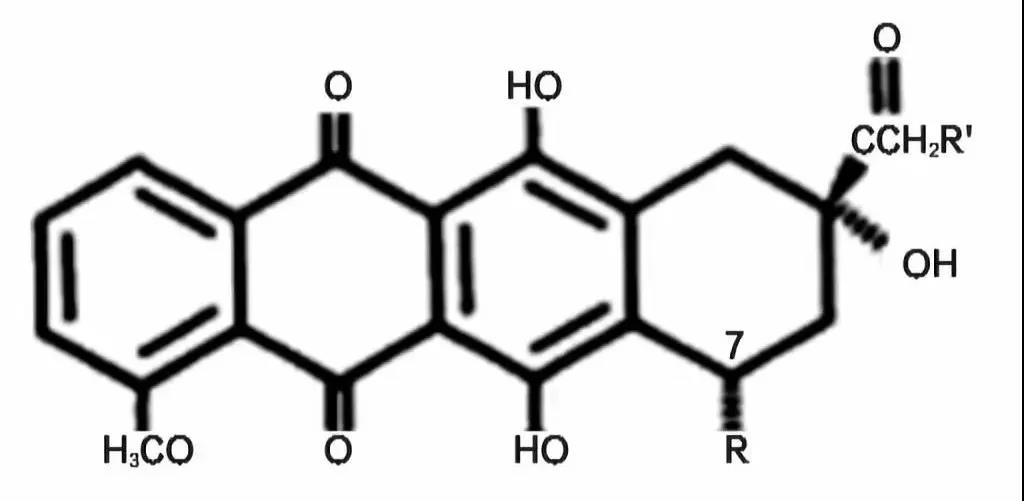
蒽环类药物
蒽环类药物包括柔红霉素(DNR)、阿霉素(ADM)又称多柔比星、表阿霉素(EPI)又称表柔比星、吡喃阿霉素(THP)又称吡柔比星、米托蒽醌(MIT)和卡柔比星等。
一 蒽环类药物如何发挥抗肿瘤作用?
* 蒽环类药物主要通过以下机制抗肿瘤:
* 嵌入DNA碱基对之间,干扰DNA转录、信使核糖核酸合成;
* 促使拓扑异构酶Ⅱ裂解DNA,破坏其3级结构;
抑制DNA多聚酶Ⅰ,抑制DNA合成;
产生氧自由基,破坏细胞膜功能(这与心脏毒性相关)
蒽环类药物对于G1和S期细胞最为敏感,蒽环类药物在低浓度时,细胞先呈指数杀伤;高浓度时,杀伤能力与药物浓度呈正相关性。
二 蒽环类药物的临床应用?
1 乳腺癌
用于乳腺癌的蒽环类药物主要包括多柔比星、表柔比星、柔红霉素、去甲氧柔红霉素、阿克拉霉素、吡柔比星(吡喃阿霉素)、脂质体阿霉素、脂质体去甲氧柔红霉素等,覆盖了术后辅助、术前新辅助、复发转移后等多个治疗阶段。
1. 辅助治疗中含蒽环类药物方案
蒽环类药物是早期乳腺癌辅助化疗的基石。相对于CMF方案,含蒽环类药物的方案能够给患者带来更多获益。在蒽环类药物基础上联合紫杉类药物后可进一步增加获益,虽然这种获益并非在所有患者中均出现,但目前循证医学依据并不足以支持在紫杉类药物为基础的化疗方案中“去蒽环”。
辅助化疗方案中的蒽环类药物剂量通常较晚期乳腺癌使用的剂量大,一般推荐首次给药剂量不低于推荐剂量的85%,后续剂量应根据患者具体情况和初始治疗后的不良反应决定是否调整,但不宜低于推荐剂量的50%。
剂量密集化疗可对高危因素患者提供增加疗效的可能性,能够进一步降低约15%的乳腺癌复发和死亡。
国内专家组关于HER-2阴性乳腺癌常用含蒽环类药物化疗方案的推荐见表1,关于HER-2阳性乳腺癌常用含蒽环类药物化疗方案推荐见表2(含有未在国内上市药物的相关方案暂不列入)。
表1:HER-2阴性乳腺癌辅助治疗常用的含蒽环类药物方案
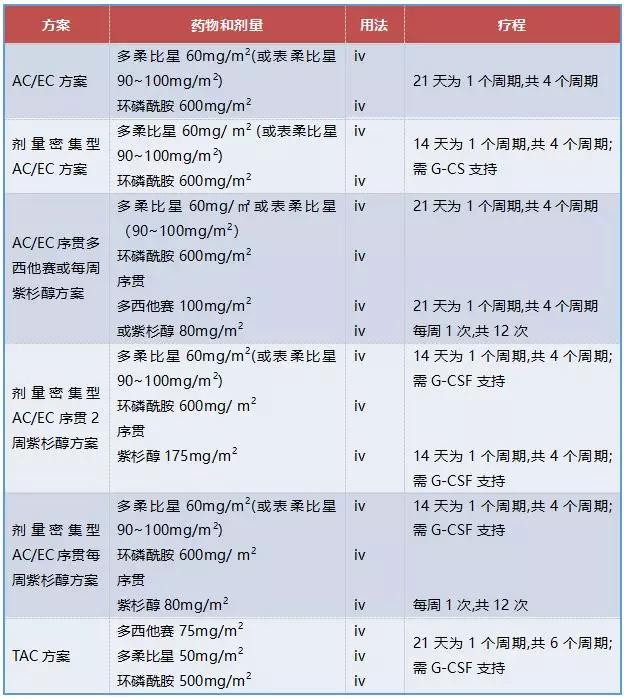
表2:HER-2阳性乳腺癌辅助治疗常用的含蒽环类药物方案
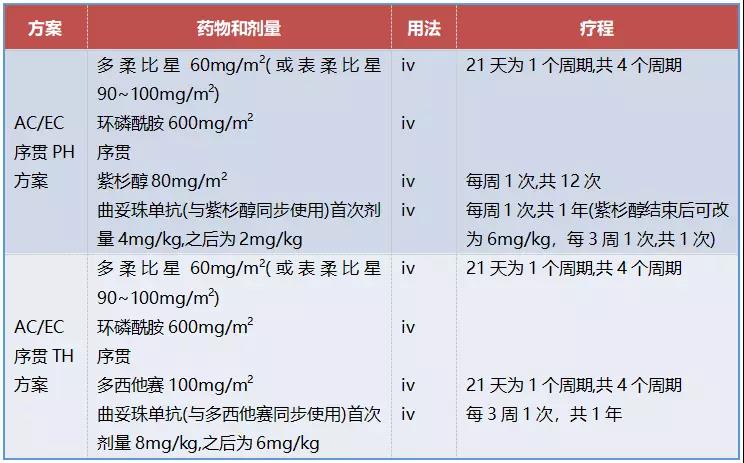
2. 新辅助治疗中含蒽环类药物方案
蒽环类同样是乳腺癌新辅助化疗的重要药物,可增加pCR率;与辅助化疗类似,无论是HER-2阴性还是HER-2阳性乳腺癌,目前新辅助化疗大多是在含蒽环类方案基础上联合或序贯紫杉类药物以增加病理完全缓解(pCR)率。
含蒽环类的TEC方案较不含蒽环类的TC方案的生存结果更佳,pCR率有更高的趋势,在三阴性乳腺癌亚型中尤其突出。
虽然目前部分新辅助治疗研究进行了不含蒽环类方案的尝试,但远期生存结果尚不成熟,新辅助化疗完全摒弃蒽环类药物尚依据不足。
3. 晚期治疗中含蒽环类药物方案
晚期乳腺癌患者无法根治,主要目的是延长生存和改善生活质量。对于未使用过蒽环类药物或使用过蒽环类药物但复发间隔较长的患者,可以在复发转移后选用或再用,可以单药,也可以联合给药(如AC、EC等)。
在未证明蒽环类耐药且未超累积剂量限制的晚期乳腺癌患者中,可以考虑单药或联合使用蒽环类药物,但需定期进行安全性评估。不同蒽环类药物的不良反应有所差异,脂质体阿霉素、表柔比星、吡柔比星的心脏毒性要轻于多柔比星,在临床实践中需依据患者的情况进行个体化选择。
2 白血病
1. 急性髓细胞性白血病(AML)
年龄<60岁以及一些老年AML患者,诱导缓解治疗主要指7天连续输注阿糖胞苷联合蒽环类药物3天,即所谓的“7+3”方案。
在非老年患者中,去甲氧柔红霉素组完全缓解(CR)率优于柔红霉素组。米托蒽醌主要用于复发难治性白血病以及白血病的巩固和维持治疗。
2. 成人急性淋巴细胞白血病(ALL)
ALL的诱导治疗都是基于长春新碱、蒽环类抗生素和强的松的“骨架”而组成的。单纯长春新碱和强的松联合治疗能够诱导35%~65%的完全缓解率,在此基础上添加蒽环类药物,能够使完全缓解率升至均78%。
3. 慢性淋巴细胞白血病(CLL)
以蒽环类药物为基础的化疗方案,如CHOP(环磷酰胺,吡柔比星,长春碱,强的松)方案或者CAP方案(环磷酰胺、阿霉素、强的松)一线治疗CLL有58%~72%的总有效率。
单药嘌呤类似物氟达拉滨相对联合化疗具有同样的效果,所以蒽环类药物为基础的化疗方案已经不再作为未经治疗的CLL患者的单一治疗选择。但CHOP方案与单克隆抗体利妥昔单抗的联合用药仍然是转化型CLL的一个有效的治疗方案。
4. 复发CLL的挽救治疗
复发CLL的挽救治疗无标准方案。
晚期复发的患者(传统单药化疗缓解持续时间>1年或者当前的免疫化疗缓解持续时间>2年),可以重复原治疗方案。患者缓解期短,早期复发的患者需更换方案治疗。
蒽环类药物表柔比星同氟达拉滨(FE)联合应用对复发的CLL患者有显著的疗效,但是并不优于FC方案。
3 淋巴瘤
阿霉素是淋巴瘤化疗方案中最经典的蒽环类药物,推荐在此类药物中作为首选药物。
(1)成熟B细胞淋巴瘤
1)弥漫大B细胞淋巴瘤:弥漫大B细胞淋巴瘤(DLBCL)是NHL中最常见的类型,临床表现为侵袭性病程。利妥昔单抗+环磷酰胺+阿霉素+长春新碱+泼尼松(R-CHOP)方案是DLBCL标准的一线免疫化疗方案,解救治疗含有蒽环类药物的方案为MINE方案。
2)滤泡性淋巴瘤:1级和2级滤泡性淋巴瘤(FL)属于惰性淋巴瘤,3级FL特别是3b级FL的治疗等同于DLBCL。对于有治疗指征的1级和2级FL患者,可选择化疗、免疫化疗或放疗。含有蒽环类药物的化疗方案有CHOP方案,可与利妥昔单抗联合应用。二线治疗方案中含蒽环类药物的方案有利妥昔单抗+氟达拉滨+米托蒽醌+地塞米松(RFND)方案。
3)套细胞淋巴瘤:套细胞淋巴瘤(MCL)自然病程可以表现为侵袭性和惰性。初始治疗可选择的含蒽环类药物的化疗方案包括硼替佐米+利妥昔单抗+环磷酰胺+阿霉素+泼尼松(VR-CAP)、R-CHOP、调整剂量的利妥昔单抗+地塞米松+长春新碱+环磷酰胺+阿霉素并与高剂量甲氨蝶呤和阿糖胞苷交替(R-HyperCVAD)方案。
4)伯基特淋巴瘤:伯基特淋巴瘤(BL)属于高度侵袭性NHL,治疗以化疗为主, BL可选择的含蒽环类药物的化疗方案包括:CALGB10002、CODOX-M、IVAC、剂量调整的R-EPOCH或调整剂量的R-HyperCVAD。二线治疗方案中含蒽环类药物有剂量调整的R-EPOCH。
(2)成熟T细胞淋巴瘤
ALK阳性的间变大细胞淋巴瘤,推荐方案包括环磷酰胺+阿霉素+长春新碱+依托泊苷+泼尼松(CHOEP-21)方案。
对于外周T细胞淋巴瘤非特指型、ALK阴性的间变大细胞淋巴瘤、血管免疫母T细胞淋巴瘤和肠病型T细胞淋巴瘤,化疗方案首先考虑CHOEP、CHOP-14、CHOP-21或剂量调整的EPOCH;也可考虑HyperCVAD方案。二线治疗中包含蒽环类药物的方案有剂量调整的EPOCH方案和MINE方案。
鼻型结外NK/T细胞淋巴瘤(EN⁃KL)对CHOP方案化疗疗效欠佳,目前不推荐含蒽环类化疗方案用于此类型淋巴瘤的治疗。
表3 淋巴瘤常用蒽环类药物化疗方案

续表3 淋巴瘤常用蒽环类药物化疗方案
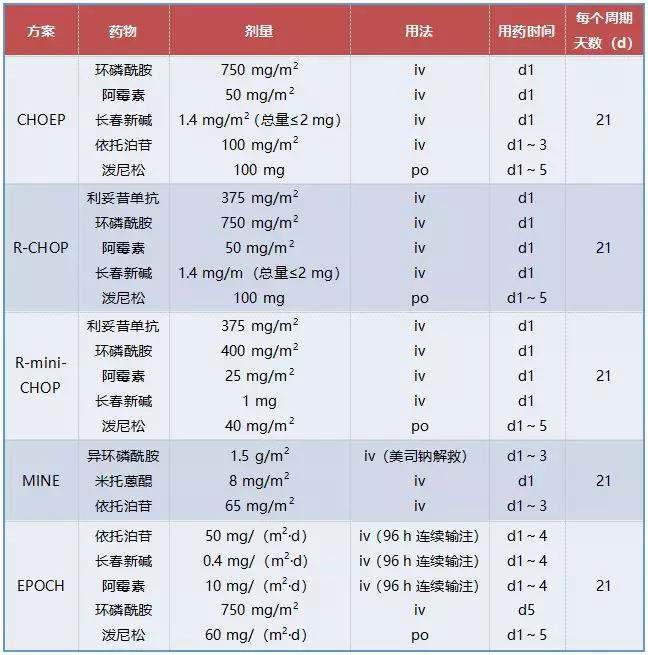
三 蒽环类药物这些不良反应需注意!
1. 心脏毒性
心脏毒性是蒽环类药物最为严重的不良反应,超过50%患者在给予蒽环类药物数年后可发生左心室亚临床超声变化,与其累积剂量呈正相关,因此早期监测和积极预防蒽环类药物引起的心脏毒性显得尤为重要。
右丙亚胺是公认的心脏保护剂,其他包括辅酶Q10、左卡尼汀、N-乙酰半胱氨酸、抗氧化剂(VC和VE等)以及其他的铁螯合剂(如去铁敏和EDTA)等或许也具有一定的心脏保护效果。
2. 骨髓抑制
骨髓抑制是蒽环类药物常见的不良反应,可通过给予重组人粒细胞集落刺激因子(rhG-CSF)、重组人粒细胞-巨噬细胞集落刺激因子(rhGM-CSF)、促血小板生成素(TPO)和成分输血等治疗来解决。
3. 消化道反应
可通过给予止吐药及肾上腺皮质激素来防治呕吐,常用药物包括恩丹司琼、格拉司琼、阿瑞匹坦等。
4. 膀胱局部反应
膀胱癌患者接受蒽环类药物膀胱灌注时不良反应主要以膀胱局部表现为主;膀胱灌注所致化学性膀胱炎的严重程度与灌注剂量、频率相关,少数患者可出现尿道狭窄或过敏反应。
5. 药物外渗
如在输液过程中出现外渗或漏出血管,应立即停止输液、尽量回抽药物,并应用1%次氯酸钠溶液处理局部,浸泡过夜最佳,然后用水冲洗。
6. 脱发
蒽环类药物导致的脱发属于暂时性脱发。
参考文献
[1] 胡夕春,张剑,陈德滇,傅佩芬,范志民,何建军,金锋,李卉,陆劲松,刘晓安,刘真真,毛大华,毛杰,欧阳取长,盛湲,王海波,王坤,王树森,王圣应,王晓稼,王永胜,杨其峰,张建国,张强.中国蒽环类药物治疗乳腺癌专家共识[J].中国肿瘤临床,2018,45(03):120-125.
[2] 吕跃,侯健,纪春岩,金洁,胡建达,罗建民,方美云,李艳,江明,白海,张广森,杨同华,李文倩,陈国安.中国蒽环类药物在白血病治疗中的临床应用专家共识[J].中国肿瘤临床,2018,45(03):117-119.
[3] 石远凯,孙燕,马军,王华庆,双跃荣,白鸥,孙秀华,何小慧,宋永平,李玉富,吴密璐,沈丽达,张会来,张明智,张清媛,苏航,邹立群,陈国安,金川,林桐榆,胡建达,姜文奇,高玉环,黄昱,姜时雨.中国蒽环类药物治疗淋巴瘤专家共识[J].中国肿瘤临床,2018,45(03):113-116.
[4] 石远凯,巴一,冯继锋,吕跃,许建萍,何小慧,张宇辉,张剑,张健,杨林,周利群,胡夕春,侯健,蔡林,刘鹏,黄昱,姜时雨,孙燕.中国蒽环类药物特性专家共识[J].中国肿瘤临床,2018,45(03):110-112.























