作者丨石汉平
来源丨医学界肿瘤频道
恶液质(Cachexia)是以骨骼肌块持续下降为特征的多因素综合征,其病理生理特征是摄食减少、代谢异常等因素综合作用引起的蛋白质及能量负平衡[1]。
恶液质患者骨骼肌块减少、蛋白质代谢异常、血浆蛋白质水平降低的治疗手段有多种,如促进食欲、抑制炎症反应、体育锻炼、促进蛋白质合成、直接补充蛋白质等,其中补充蛋白质/氨基酸(aminoacid,AA)是一个最为直接的治疗手段。本文讨论恶液质患者的蛋白质应用。
一 补充蛋白质有效吗?

1. 降低死亡率
WeijsPJ等[2]2012年发表了一个前瞻性观察报告:886例连续入院的内外科混合ICU机械通气患者,平均年龄(63±16)岁,BMI26±6,非直接测热法指导能量供给,蛋白质供给量最少1.2g/(kg∙d),计算机械通气期间的累积摄入量,Cox回归分析蛋白质+能量达到目标需要量、能量达到目标需要量、蛋白质及能量均未达到目标需要量三种情况下,28天死亡率。
其结果发现:蛋白质+能量双达标、能量单达标、蛋白质及能量均未达标三组的能量摄入(实际摄入量/目标需要量%,下同)分别为99%±5%、96%±5%、75%±15%,蛋白质摄入量分别为112%±12%、89%±10%、72%±20%。蛋白质+能量双达标、能量单达标的28天死亡风险比(hazardratios,95%CI)分别为0.47(0.31-0.73)、0.83(0.67-1.01),两者相差非常显著。
提示:蛋白质及能量双达标可以减少50%的死亡率,而单纯能量达标不能减少死亡率。这个研究虽然是针对危重病患者,但是其结果对恶液质患者有借鉴作用,充分说明了蛋白质达标的重要性。所以,对恶液质患者营养支持时,应该强调蛋白质、能量双达标。
2. 改善蛋白质代谢
2013年BozzettiF等[3]就静脉补充蛋白质/AA是否有益于肿瘤患者的问题进行了研究,他们从Pubmed上收集1970'2011年静脉应用AA于肿瘤患者的研究报告,短期代谢研究发现:
• 补充2g/(kg∙d)AA(含必需氨基酸,essentialAA,EAA0.5g/(kg∙d)),显著改善了严重营养不良患者的蛋白质代谢,整体蛋白质合成(WBPS)显著升高;
• 对轻中度营养不良的肿瘤患者补充1.5g/(kg∙d)AA(总AA1.25'1.7g/(kg∙d),其中EAA0.5'1.2g/(kg∙d)),可以弥补口服摄入不足,使得抗肿瘤治疗继续进行,整体蛋白质分解(WBPC)保持不变或下降。
• 补充1.4'2.0g/(kg∙d)(EAA0.8'1.2g/(kg∙d))AA,肌肉蛋白质合成(MPS)保持不变甚至增加;
• 补充1.4'1.7gAA/(kg∙d)(EAA0.7'0.8g/(kg∙d)),肌肉蛋白质分解(MPC)保持不变(没有继续下降)。
3. 提高血浆蛋白质水平
DeCiccoM等[4]报告了完全胃肠外营养(TPN)对肿瘤化疗患者毒副反应的前瞻性交叉研究,43例肿瘤患者,其中19例营养正常(A组),24例营养不良(B组),两组患者在化疗时分别先后进行13天的TPN(35kcal/(kg∙d),1.4g/(kg∙d)AA)或标准口服饮食,A组第一疗程化疗的同时接受TPN,21'28天后进行第二疗程化疗,口服饮食,无PN;B组相反,第一疗程化疗时无PN,21'28天后进行第二疗程化疗的同时进行PN。
作者发现,营养正常的患者即使接受TPN,患者的营养参数也没有变化;营养不良的患者,化疗时实施TPN显著提高了前白蛋白、视黄素结合蛋白及氮平衡水平,P<0.02;没有接受TPN的患者,其前白蛋白及氮平衡水平显著下降。
实验结果说明,营养支持及蛋白质补充只应该局限于营养不良及恶液质的肿瘤患者。
4. 提高抗肿瘤治疗耐受性
SikoraSS等[5]观察了营养支持对食管癌患者化疗毒副反应的影响,45例连续入院食管癌患者,手术前接受放化疗,随机分为PN组(n=30,1.5g/(kg∙d)AA)及无PN组(n=15)。
结果发现:与无PN患者相比,PN组患者实际接受化疗剂量更大,更加接近目标化疗剂量,化疗完成率更高(5-FU 86.4% vs 68.8%,P=0.02;顺铂90.8% vs 78.2%,P=0.05;干扰素α 95.4% vs 79.8%,P=0.05)。尽管PN组患者化疗剂量更大,但是其化疗毒副反应、手术后并发症及死亡率却没有明显增加。
PN组与无PN组比较:血液系统严重毒副(III/IV级)反应为93.3% vs 86.6%,P=0.59;胃肠道III/IV级毒副反应为56.67% vs 33.3%,P=0.2;手术后并发症51.8% vs 61.5%,P=0.73;手术后死亡率7.4% vs 7.6%,P=1.00。
LundholmK等[6]报道了营养支持及蛋白质补充对肿瘤恶液质患者生存率的影响,309例恶液质患者,体重平均下降9%'10%,随机分为口服饮食+家庭肠外营养(HPN,总蛋白质1.4'1.7g/(kg∙d),0.8g口服,0.6'0.9g静脉输注)及单纯口服饮食两组,HPN平均治疗46天。
意向治疗分析(intention-totreatanalysis)发现,HPN组营养平衡明显改善(P<0.03);实际治疗分析(as-treatedanalysis)发现,HPN组患者生存时间延长(P<0.01),能量平衡改善(P<0.001),体脂增加(P<0.05),身体活动能力增强(P<0.04)。
二 如何补充蛋白质?

1. 提高蛋白质(供给量)比例
由于肿瘤恶液质的特征是蛋白质减少,所以直接提高饮食的蛋白质比例是自然而然的想法。
HoVW等[7]报告了高蛋白喂养对荷瘤小鼠的影响,5'8周龄C3H/HeN小鼠、Rag2M小鼠分别接种鼠鳞状细胞癌细胞(SCCVII)、人结肠癌细胞株细胞(HCT-116),分别用三种配方高蛋白(I:碳水化合物15.6%,蛋白质58.2%,脂肪26.2%;II:碳水化合物8.0%,蛋白质69.4%,脂肪22.6%;III:碳水化合物10.6%,蛋白质63.5%,脂肪25.9%)及普通饮食(碳水化合物55.2%,蛋白质23.2%,脂肪21.6%)喂养。
他们发现:与普通饮食喂养小鼠相比,高蛋白饮食喂养小鼠肿瘤(鼠肿瘤及人肿瘤)生长缓慢,血糖、胰岛素及乳酸水平均降低,mTOR抑制剂CCI-779及COX-2抑制剂塞来昔布试验提示低糖高蛋白喂养具有协同抗肿瘤效应。
遗传基因改造的HER-2/neu诱导乳腺癌小鼠喂养试验有惊人的发现:普通饮食喂养组50%小鼠发生乳腺癌,而高蛋白喂养组无一只小鼠发生乳腺癌;普通饮食喂养小鼠只有一只小鼠活到正常的寿命年龄,而高蛋白喂养组50%小鼠超过正常寿命年龄。
2. 补充性肠外营养(SPN)
1968年DudrickSJ等[8]报告用PN成功喂养犬,并获得正常生长发育后不久,1974年他们的小组又第一次将PN应用于肿瘤患者[9]。早期的PN多数为高热卡的TPN,目前多数为SPN,以静脉输注的方式补充口服不足。
HasenbergT等[10]2010年报告82例无法根治的晚期结直肠癌患者,随机分为口服饮食+SPN及单纯口服饮食两组,两组患者总热卡及蛋白质摄入量相同,作者发现:6周后SPN组体细胞块(bodycellmass,BCM)显著高于对照组,18周后SPN组患者生活质量显著改善,36周后SPN组患者BMI、白蛋白水平显著高于对照组。SPN组患者化疗相关毒副反应显著少于对照组,而生存时间显著延长。
3. 口服营养补充(ONS)
恶液质的一个重要特征是肌肉减少,ONS是最为简便的能量及蛋白质补充方法。研究发现,直接口服复方AA,可以明显提高患者的瘦肉组织重量,提高胰岛素敏感性。
SolerteSB等[11]将41例年龄66'84岁的老年人随机分为安慰剂及复方AA治疗组,复方AA治疗组补充8gEAA(70.6kcal)/d,每天分两次于10am及5pm口服,持续6'18个月。
发现:复方AA治疗组大腿、上臂及躯干组织的瘦肉组织重量明显增加,空腹血糖、血浆胰岛素水平及胰岛素抵抗指数、血浆TNFα水平明显下降,血浆胰岛素样生长因子(insulin-likegrowthfactor-1,IGF-1)及IGF-1/TNFα比值显著升高。
作者认为口服补充蛋白质可以显著提高患者的瘦肉组织重量,其机制与提高胰岛素敏感性及IGF'1促进合成代谢有关。(图1)
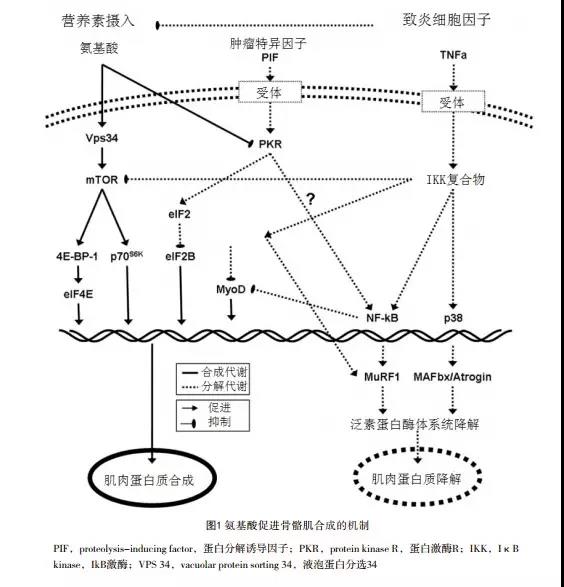
三 补充什么蛋白质?

1. 支链氨基酸(BCAA)
肿瘤恶液质患者由于骨骼肌分解,其血浆BCAA水平往往升高,补充外源性BCAA可以达到抑制蛋白质分解、促进蛋白质合成的作用。
HunterDC等[12]报告,9例腹腔腺癌患者分别随机先后接受普通TPN(BCAA19%)或富含BCAA的TPN(BCAA50%),两种TPN配方中的总热卡及总氮量相等,采用13C亮氨酸及14C酪氨酸作为示踪剂,发现:富含BCAA的TPN治疗患者,亮氨酸及酪氨酸内流(flux)显著升高,亮氨酸氧化显著增强,酪氨酸氧化显著下降;白蛋白分数合成率显著升高。
酪氨酸示踪发现:整体蛋白质合成及降解均显著增强。亮氨酸示踪发现:整体蛋白质合成及降解也增强,但是无显著差异。
作者认为:酪氨酸氧化下降(提示蛋白质利用改善)、蛋白质及白蛋白合成增加,说明BCAA对肿瘤恶液质患者有明显的正效应。
2. 水解蛋白
众多研究已经显示,与整蛋白相比,蛋白水解物(水解蛋白)更快吸收,更快改善氮平衡。
KoopmanR等[13]比较了整蛋白及水解蛋白的消化与吸收情况,10位老年男性志愿者,分别随机先后一次性口服35g酪蛋白(casein,CAS)或酪蛋白水解物(hydrolyzedcasein,CASH),6小时后检测血液及肌肉标本,作者发现:与口服CAS相比,口服CASH后外源性苯丙氨酸出现率显著升高(P<0.001),内脏提取(splanchnicextraction)显著降低(P<0.01),血浆AA浓度升高25%'50%(P<0.01),肌肉蛋白质合成增加。
实验结果提示:口服水解蛋白比口服整蛋白消化、吸收更快,餐后AA可利用度更高,食物蛋白质更多参与肌肉蛋白质合成。
除了吸收更快之外,水解蛋白对肿瘤还有直接的抑制作用。
AttaallahW等[14]在动物实验中比较观察了乳清蛋白(wheyprotein,WP)及乳清蛋白水解物(wheyproteinhydrolyzate,WPH)对肿瘤的影响,Wistar白化成年雄性大鼠,以氧化偶氮甲烷(azoxymethane,AOM)和硫酸葡聚糖钠(dextransodiumsulfate,DSS)诱导结肠癌,在正常饮食、饮水情况下,分别以等氮WP或WPH灌胃,每周2次,连续15周。
作者发现,WPH组大鼠体重显著增加,与假处理、肿瘤及肿瘤+WP相比,差异显著,P=0.0013。其余各组大鼠体重无显著差异。所有接种AOM及DSS的处理组(肿瘤组,肿瘤+WP,肿瘤+WPH)均有肿瘤生长,所有未接种AOM及DSS的大鼠(假处理、WP、WPH)无一发生肿瘤。肿瘤组、肿瘤+WP组91.9%的大鼠生长肿瘤,肿瘤+WPH组只有33.3%的大鼠生长肿瘤,相差非常显著,P=0.004。
病理学观察发现:肿瘤组、肿瘤+WP组、肿瘤+WPH组结肠腺瘤的发生率分别为90.9%、63.6%、44%,弥漫性结肠发育异常(diffusecolonicdysplasia)发生率分别为82%、91%、0。
结论认为:与乳清蛋白相比,乳清蛋白水解物具有更强的肿瘤预防与抑制作用。
3. 谷氨酰胺
谷氨酰胺在肿瘤恶液质患者的作用已经有较多研究。
YoshidaS等[15]观察了①荷瘤动物是否存在谷氨酰胺缺乏,②化疗期间补充谷氨酰胺是否可以促进蛋白质代谢,③口服谷氨酰胺是否可以改善放化疗患者的免疫功能及肠道屏障功能。
他们用AH109A肝细胞瘤细胞或吉田肉瘤细胞接种雄性14Donryu大鼠诱导肿瘤,用U-C-谷氨酰胺输注检测谷氨酰胺产量,用U-14C-精氨酸输注检测精氨酸向谷氨酰胺的转化,用1-14C-亮氨酸输注观察谷氨酰胺对蛋白质代谢的影响。
临床研究中,他们将13例放化疗食管癌患者随机分为对照组及谷氨酰胺补充组(30g/d,连续4周)。发现:荷瘤大鼠尽管谷氨酰胺产量升高、精氨酸向谷氨酰胺转化增加,但是血浆及肌肉谷氨酰胺水平降低;化疗期间经PN补充谷氨酰胺可以降低整体蛋白质降解;食管癌患者放化疗期间口服补充谷氨酰胺可以增强淋巴细胞有丝分裂功能、降低肠道黏膜通透性。
结论认为:荷瘤宿主组织谷氨酰胺缺乏,谷氨酰胺补充可以减少肌肉蛋白质丢失,增强免疫功能,保护肠道黏膜屏障。
结论
尽管蛋白质在人体代谢与功能中有着无可比拟的作用,但是,氮平衡在肿瘤患者的作用远远没有得到应有的重视。
最新版(2009年)的ASPEN指南根本没有提到肿瘤患者的AA需要量。最新版(2009年)ESPEN指南对AA的描述也只有寥寥数字:肿瘤患者的AA需要量推荐范围最少为1g/(kg∙d)到目标需要量的1.2'2.0g/(kg∙d)之间。
综合多项研究,BozzettiF等认为,肿瘤恶液质患者蛋白质的总摄入量(静脉+口服)应该达到1.8'2.0g/(kg∙d),BCAA应该达到≥0.6g/(kg∙d),EAA应该增加到≥1.2g/(kg∙d)。
• 严重营养不良肿瘤患者的短期冲击营养治疗阶段,蛋白质给予量应该达到2.0g/(kg∙d);
• 轻中度营养不良肿瘤患者的长期营养补充治疗阶段,蛋白质给予量应该达到1.5g/(kg∙d)[1.25'1.7g/(kg∙d)];
• 日常饮食不足时,应该口服营养补充,口服营养补充仍然不足时,应该给予静脉补充。
根据恶液质状态下的病理生理变化特征、蛋白质代谢的特点,结合现有的研究结果,笔者建议提高肿瘤患者的蛋白质供给量,优先使用蛋白质水解物(水解蛋白)及短肽类制剂,提高BCAA比例[16]。
参考文献:
1. Fearon K, Strasser F, Anker SD, et al. Definition and classification of cancer cachexia: an international consensus. Lancet Oncol.2011;12(5):489-495.
2. Weijs PJ, Stapel SN, de Groot SD, et al. Optimal protein and energy nutrition decreases mortality in mechanically ventilated,critically ill patients: a prospective observational cohort study.JPEN J Parenter Enteral Nutr. 2012;36(1):60-68.
3. Bozzetti F, Bozzetti V. Is the intravenous supplementation of amino acid to cancer patients adequate? A critical appraisal of literature. Clin Nutr. 2013;32(1):142-146.
4. De Cicco M, Panarello G, Fantin D, et al. Parenteral nutrition in cancer patients receiving chemotherapy: effects on toxicity and nutritional status. JPEN J Parenter Enteral Nutr. 1993;17(6):513-518.
5. Sikora SS, Ribeiro U, Kane JM 3rd, et al. Role of nutrition support during induction chemoradiation therapy in esophageal cancer.JPEN J Parenter Enteral Nutr.1998;22(1):18-21.
6. Lundholm K, Daneryd P, Bosaeus I, et al. Palliative nutritional intervention in addition to cyclooxygenase and erythropoietin treatment for patients with malignant disease: Effects on survival,metabolism, and function. Cancer. 2004;100(9):1967-1977.
7. Ho VW, Leung K, Hsu A, et al. A low carbohydrate, high protein diet slows tumor growth and prevents cancer initiation. Cancer Res. 2011;71(13):4484-4493.
8. Dudrick SJ, Wilmore DW, Vars HM, et al. Long-term total parenteral nutrition with growth, development, and positive nitrogen balance. Surgery 1968;64:134e42.
9. Copeland EM, Macfayden BV Jr, Dudrick SJ. Intravenous hyperalimentation in cancer patients. J Surg Res. 1974;16(3):241-247.
10. Hasenberg T, Essenbreis M, Herold A, et al. Early supplementation of parenteral nutrition is capable of improving quality of life,chemotherapy-related toxicity and body composition in patients with advanced colorectal carcinoma undergoing palliative treatment: results from a prospective, randomized clinical trial.Colorectal Dis. 2010;12(10 Online):e190-199.
11. Solerte SB, Gazzaruso C, Bonacasa R, et al. Nutritional supplements with oral amino acid mixtures increases whole-body lean mass and insulin sensitivity in elderly subjects with sarcopenia. Am J Cardiol. 2008;101(11A):69E-77E.
12. Hunter DC, Weintraub M, Blackburn GL, et al. Branched chain amino acids as the protein component of parenteral nutrition in cancer cachexia. Br J Surg.1989;76(2):149-153.
13. Koopman R, Crombach N, Gijsen AP, et al. Ingestion of a protein hydrolysate is accompanied by an accelerated in vivo digestion and absorption rate when compared with its intact protein. Am J Clin Nutr. 2009;90(1):106-115.
14. Attaallah W, Yilmaz AM, Erdoğan N, et al. Whey protein versus whey protein hydrolyzate for the protection of azoxymethane and dextran sodium sulfate induced colonic tumors in rats. Pathol Oncol Res. 2012;18(4):817-822.
15. Yoshida S, Kaibara A, Ishibashi N, et al. Glutamine supplementation in cancer patients. Nutrition. 2001;17(9):766-768.
16. 石汉平. 肿瘤新疗法----代谢调节治疗. 肿瘤代谢与营养电子杂志. 2014;1(1):3-5.























